蝗虫留给人们的最震撼的印象莫过于贪婪掠食。蝗群过后,寸草皆无。据科学估计1平方公里的蝗群一天能吞掉3.5万人的口粮。蝗灾往往引发严重经济损失,甚至导致粮食短缺进而发生饥荒。蝗虫巨大的取食量受什么调控一直是个谜。蝗虫最显著特征之一是基因组特别巨大,是果蝇的30多倍,是人类的2.5倍。那么,蝗虫食量大与基因组大小有关吗?昆虫不同物种间基因组大小的差异可以相差170多倍,但是并非是由于基因数量的不同造成的,主要是由于不同类型的转座子元件大规模扩张、缺失和分化所导致的数量差异。蝗虫的内含子既大又富含转座子元件,由于转座子元件的大规模扩张会同时发生在基因间区和基因内部,导致基因组的“肥胖化”,并且产生了大量转座子相关联的piRNA表达。
飞蝗具有大型基因组特点(6.9 Gb)。转座子元件大规模扩张导致飞蝗基因组的“肥胖化”和基因结构的“松散化”,进而引起超长内含子的出现和大量转座子元件相关的piRNA表达。中国科学院北京生命科学研究院康乐院士团队利用飞蝗为研究系统,发现飞蝗基因组采用“piRNA靶向超长内含子正向促进剪切”应对基因组的“肥胖化”和“松散化”的特有机制(Liu,BMC Biology,2021)。这项研究结果为理解大型基因组的特有转录启动和RNA加工模式提供重要的理论依据。飞蝗具有巨大的基因组,它会产生大量的转座子元件相关联的piRNA。现有的研究发现piRNA主要在生殖系统发挥作用,那么在其它系统特别是体细胞中产生的大量的piRNA在发挥什么作用呢?
中国科学院北京生命科学研究院康乐院士团队围绕蝗虫贪食问题展开基因组学研究,并取得重大发现。2022年1月5日,欧洲分子生物学组织报告(EMBO Reports)在线发表了研究论文“Piwi/piRNAs control food intake by promoting neuropeptide F expression in locusts”。
该项研究发现飞蝗更具有典型的昆虫PIWI蛋白家族特征,并且证明飞蝗大脑中存在与转座子元件相关的piRNA表达。降低Piwi1基因表达能够导致飞蝗取食量减少、合成代谢抑制、体重减轻。进一步实验结果表明神经肽NPF1是Piwi1基因的下游主效靶标基因,其调控模式依赖piRNA的参与。飞蝗转座子大规模扩张引起基因结构的“松散化”,导致出现大量的超长内含子出现。具有超长内含子的基因依赖分支点(branch point)采用外显子定义(exon definition)模式进行RNA加工。细胞核内piRNA能够靶向NPF1转录前体RNA中内含子区域的分支点,避免发夹结构的形成,进行增强NPF1转录前体RNA剪切效率,起到对NPF1成熟体RNA正向表达调控的作用,从而控制飞蝗的取食。这一研究提出一种大型基因组特有的piRNA正向促进RNA剪切的分子机制。同时也是首次研究神经系统中PIWI/piRNA对取食的调控作用,并且对piRNA在基因转录后水平的分子神经生物学功能进行深入剖析。这使我们对 PIWI/piRNA 在体细胞中的功能研究有了更深入的认识。
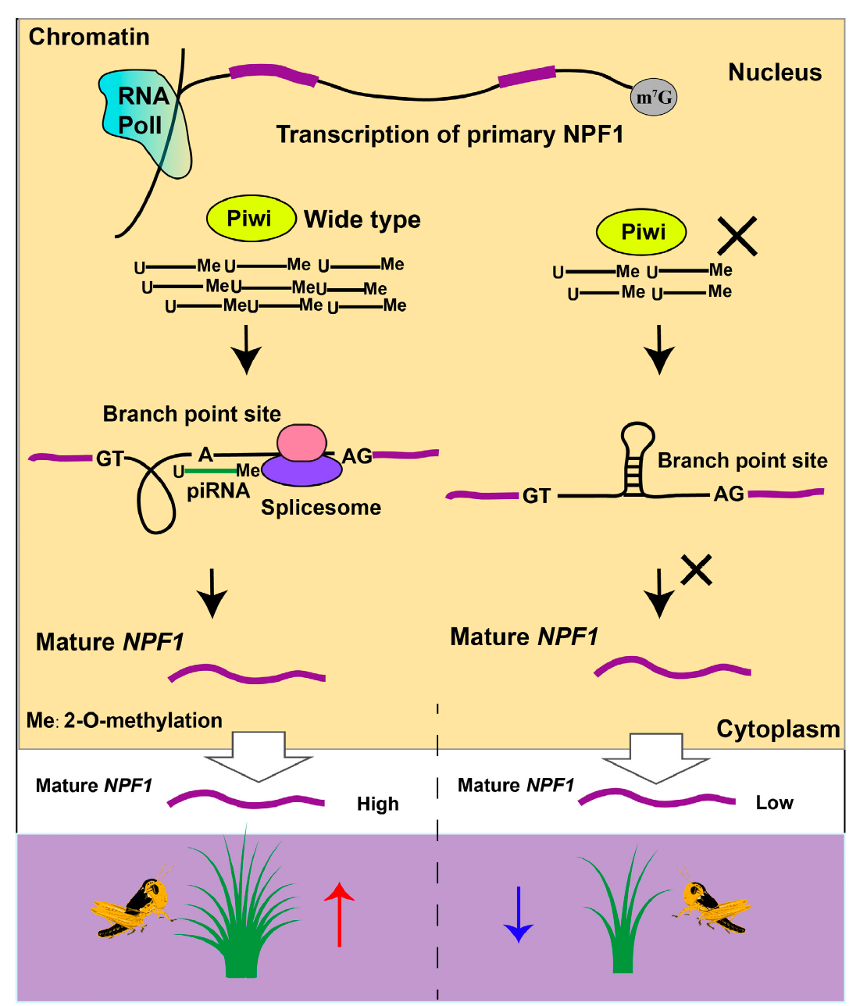
图1 PIWI/piRNA通过促进神经肽NPF来控制飞蝗取食
他们发现了控制飞蝗取食的piRNA,这一研究成果能够拓展蝗虫控制方法的认识,并且能够作为开发新型防控技术手段。当前,蝗虫防治主要依赖化学农药杀虫剂喷洒,对于自然生态环境和人类健康都存在严重影响。除了使用化学农药杀虫剂外,使用双链RNA加工成 siRNA来抑制靶基因的RNA干扰技术,也被认为是飞蝗防控的潜在绿色技术。然而,siRNA 跟靶基因在具有 11 个连续匹配碱基并且 79% 相似性 (19个碱基中匹配15个碱基) 的情况下就足以触发脱靶转录本的表达沉默。因此siRNA在很低的核苷酸序列相似性的情况下就能发挥作用,这样会引起跨物种沉默效应导致有害昆虫和无害昆虫无偏差杀灭。因此,寻找高选择性和物种特异性的新型功能分子是开发安全害虫控制方法的首要任务。幸运的是,由于 piRNA 的跨物种序列保守性非常低,基于 piRNA 的 RNA干扰防控技术可以作为防控害虫的新技术,从而避免对生态系统中其他无害昆虫的潜在脱靶效应.
博士研究生王慧敏、姜枫副研究员、硕士研究生刘翔是该论文的共同第一作者。该项目受到国家自然科学基金和中科院先导项目的资助。
论文链接:https://www.embopress.org/doi/full/10.15252/embr.202050851

