环形RNA是由pre-mRNA通过反向剪接形成的闭合环状RNA分子。在生物体内,环形RNA可发挥miRNA海绵、结合蛋白以及翻译成短肽等分子功能来调控各种生理和病理过程。与线性mRNA相比,环形RNA独特的环状结构使其具有更高的稳定性,在细胞内可以更稳定的存在。因此,环形RNA更适合作为肿瘤的分子标志物及治疗靶点。然而,目前大部分环形RNA在肿瘤发生发展中的具体调控功能与分子机制还有待深入研究。
2022年1月24日,中国科学院北京生命科学研究院赵方庆团队在国际刊物Advanced Science上发表了题为“circVAMP3 drives CAPRIN1 phase separation and inhibits hepatocellular carcinoma by suppressing c-Myc translation”的研究论文。报道了环形RNA circVAMP3通过促进CAPRIN1蛋白相分离,在细胞内形成应激颗粒(stress granules)以阻止c-Myc mRNA的翻译,进而抑制肝细胞性肝癌(HCC)的发生发展。该工作首次证实了环形RNA可以通过发挥分子骨架的功能促进相分离形成,从而调控肿瘤的增殖与迁移过程,为恶性肿瘤的研究提供了新的分子标志物和治疗靶点。
首先,研究人员通过对20对肝癌及癌旁样本的RNA-seq数据进行挖掘,筛选到了在肝癌中表达显著下调且其母本基因变化不大的环形RNA(circVAMP3)。circVAMP3由VAMP3基因的第3、4外显子通过反向剪接成环,具有与线性VAMP3基因截然不同的表达模式,并且与患者的预后显著相关。研究人员利用RNA干扰技术,通过体内外功能实验证明了circVAMP3具有抑制HCC细胞增殖和迁移的作用(图1)。
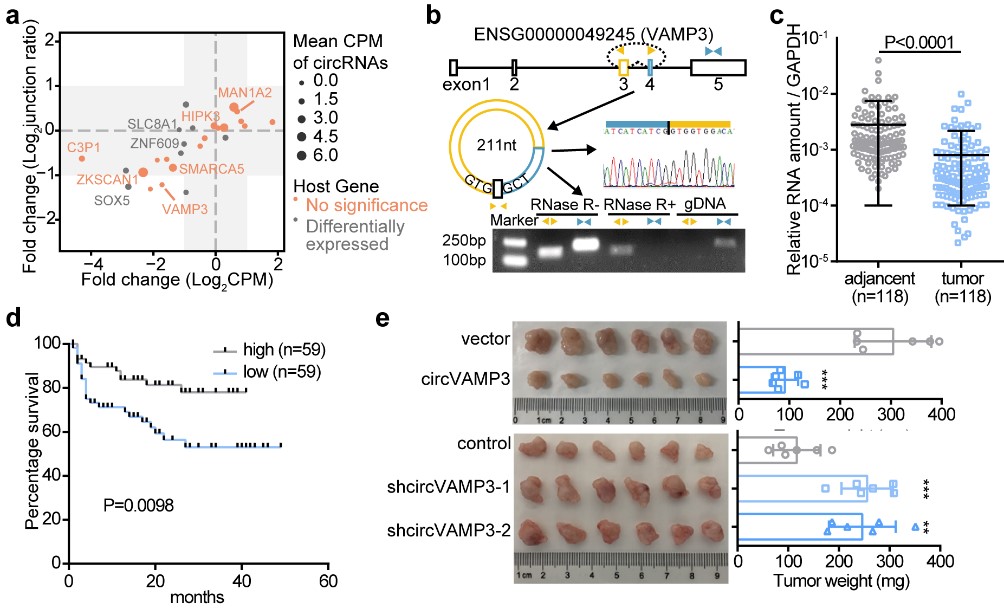
图1. circVAMP3的分子特征以及对HCC的抑制作用
接下来,他们对circVAMP3调控肝癌发生的机制进行了深入探究。通过对circVAMP3互作分子的筛选发现,circVAMP3可以作为分子骨架与 CAPRIN1蛋白的RGG结构域结合,进而招募CAPRIN1-G3BP1复合物,导致蛋白聚集并发生相分离,在细胞中促进应激颗粒的形成。尽管先前的研究表明线性RNA可调控蛋白相分离过程,该研究首次证实了环形RNA也可通过聚集蛋白促进相分离的发生(图2)。

图2. circVAMP3促进CAPRIN1蛋白相分离和细胞内应激颗粒形成
随后,研究人员进一步发现circVAMP3通过抑制c-MYC蛋白的翻译,进而抑制肝癌细胞的增殖和迁移。通过共定位研究揭示了circVAMP3通过应激颗粒抑制c-Myc翻译的分子机制(图3)。非常有意思的是,除了在肝脏中,circVAMP3在其他组织中(如脑、胃、结肠、脾脏、肺、甲状腺、肾脏等)也可以广泛表达,并且其在对应的肿瘤组织中表达量均发生下调。研究人员进一步对不同组织不同肿瘤细胞系对circVAMP3进行干扰实验,发现均可以抑制肿瘤细胞的增殖和迁移,这提示circVAMP3广泛参与了不同类型的肿瘤发生发展的普适性调控,以及其可能成为肿瘤研究共性靶标分子的潜力。
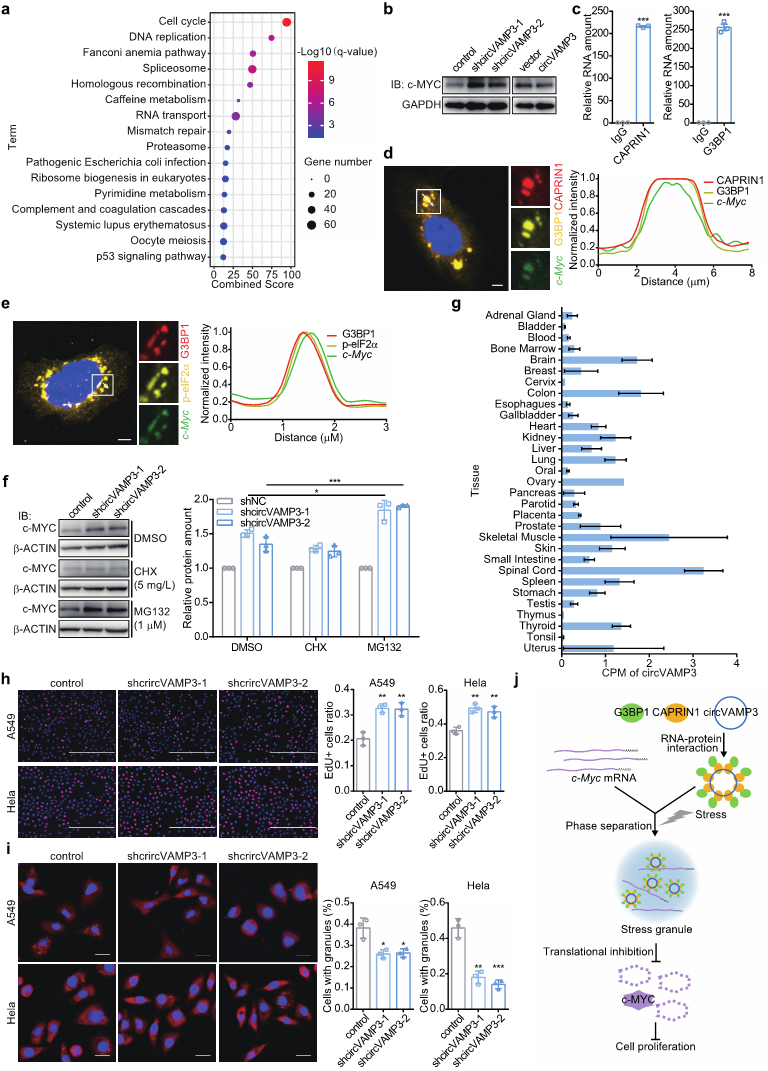
图3. circVAMP3抑制HCC细胞增殖的分子机制
综上所述,该研究首次发现了环形RNA具有促进相分离的生物学功能,并系统阐释了circVAMP3、c-Myc和应激颗粒互作对HCC发生发展的调控作用,为环形RNA分子功能研究提供了新角度。该研究揭示了circVAMP3可以作为HCC和其他恶性肿瘤的诊断以及预后判断的理想靶标分子,为环形RNA通过相分离调控肿瘤发生发展的机制研究提供了新思路。
该研究由中科院北京生命科学研究院赵方庆研究员团队完成。博士研究生陈帅、博士后曹晓菲和张金阳为共同第一作者。赵方庆团队在前期工作中建立了环形RNA识别、重建、定量和功能挖掘的技术和方法,相关研究发表在Nature Biotechnology (2021)、Nature Communications (2016, 2020)、Genome Biology (2015, 2020)、Briefings in Bioinformatics (2018)、Trends in Genetics (2018)、Trends in Biochemical Sciences (2021)、Genome Medicine (2019)、Cell Reports (2019)和Bioinformatics (2020)。这些研究丰富了我们对环形RNA的组成及结构的认识,为深入了解这一类特殊的RNA分子提供了重要工具和数据支持。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202103817

