2022年12月12日,国际著名学术期刊Advanced Science在线发表了中国科学院北京生科院孙中生团队题为“Loss-of-Function of p21-Activated Kinase 2 Links BMP Signaling to Neural Tube Patterning Defects”的研究论文。该研究聚焦神经管畸形的致病机制,综合运用神经生物学、人类遗传学、多组学等技术手段,在多种模式生物中揭示了PAK2调节背外侧铰链点形成和神经管发育及其功能异常所致神经管畸形的致病机理,对理解神经管畸形的病理机制提供了崭新视角。
神经管是中枢神经系统发育的基础,在胚胎后期发育成脑和脊柱。在脊椎动物中,神经管闭合是一个高度复杂的动态调控过程,涉及许多由遗传和表观遗传因素精确控制的细胞事件。神经管闭合异常会导致神经管畸形。神经管畸形致死率和致畸率很高,给患者家庭带来沉重的经济与精神负担。神经管畸形在全球的发生率约为1/1000,是胎儿和新生儿中最严重的出生缺陷类疾病,为仅次于先天性心脏病的第二常见出生缺陷疾病。我国是神经管畸形的高发区域。
PAK家族是一类可以调控细胞骨架的蛋白激酶。该团队在前期研究中确定了PAK2在脑发育中的重要功能,并阐明了其在自闭症发病中的分子机制(Wang et al., 2018)。在本研究中,他们发现Pak2纯和缺失小鼠在胚胎期9.5天时发育迟缓,表现出颅脊柱裂的表型。进一步研究发现在胚胎期9.5 天时, Pak2纯和缺失小鼠未能在后脑和脊柱部位抬起双侧神经板,导致背外侧铰链点形成失败。这一结果提示PAK2基因对于整个头尾胚轴的背外侧弯曲是必要的。通过分析胚胎期9.5天的转录组发现,Pak2纯和缺失小鼠的差异表达基因显著富集到初级神经管形成、前脑、中脑、后脑发育、模式特化过程和脊柱发育过程。这些差异表达基因还显著地富集于BMP信号通路。BMP信号通路的多个配体,如BMP4/5和下游Smad9的磷酸化水平,都在Pak2纯和缺失小鼠中显著增加。研究团队进一步将Smad9蛋白417位点丝氨酸突变后可减弱PAK2和Smad9蛋白的相互作用,并解除PAK2对Smad9蛋白465位点丝氨酸磷酸化的抑制。以上结果提示PAK2可通过调控Smad9蛋白的磷酸化水平,从而抑制了BMP信号通路,促使双侧神经板的抬起和神经管背外侧铰链点形成。
单细胞测序技术进一步显示,Pak2纯和缺失后可影响中胚层细胞向神经管及前脑和脊柱的分化轨迹,使得与神经管和神经管发育而成的前脑、后脑、脊柱等相关的细胞类型显著下降。与野生型胚胎相比,Pak2纯和缺失胚胎的神经管发育分数及前脑(尤其是间脑部分)发育分数降低。同时,BMP信号通路及该信号通路中的基因表达在Pak2纯和缺失胚胎中增加。提示Pak2纯和缺失胚胎中异常的分化时序是与异常的转录状态相关联的。
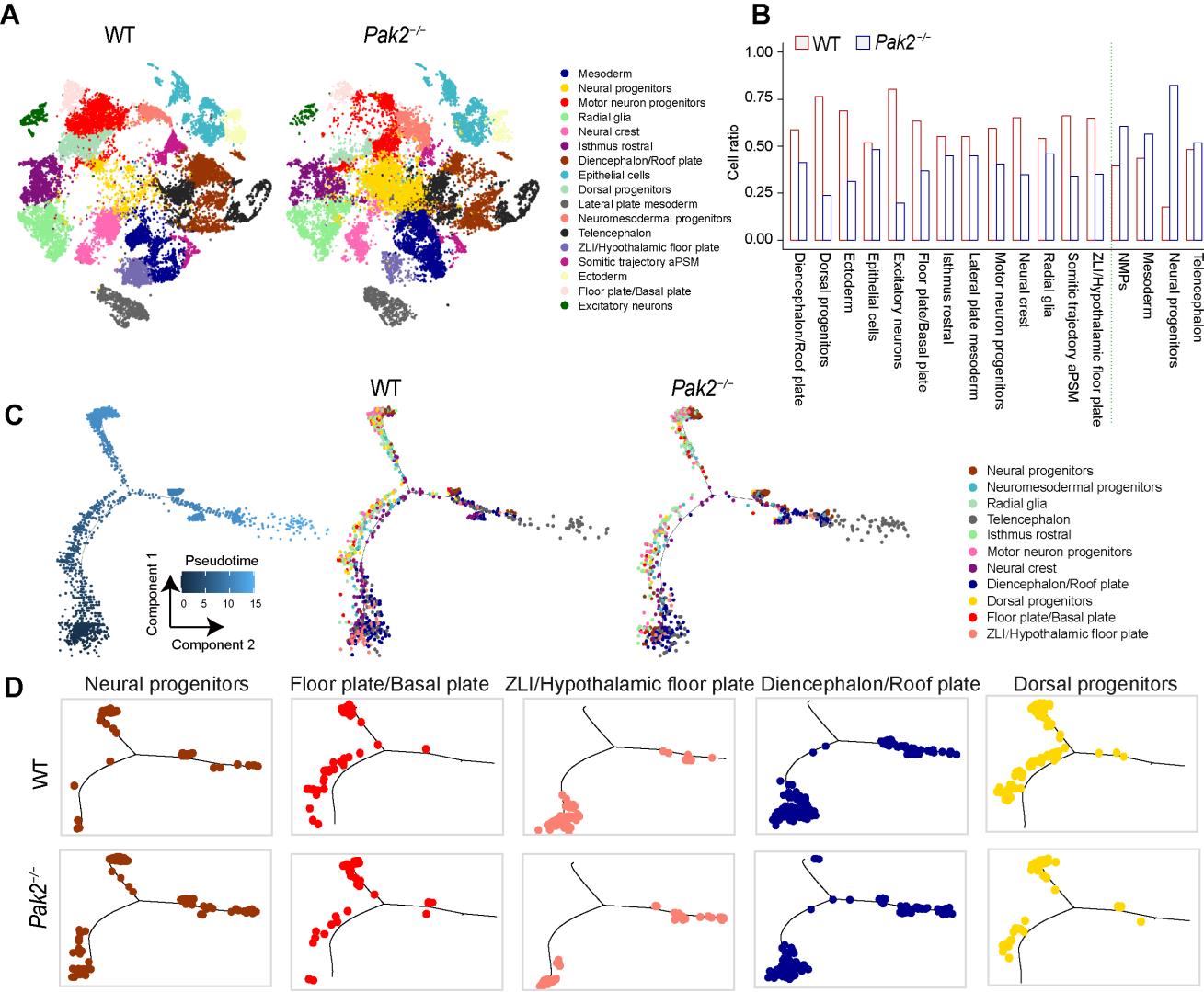
图1 Pak2纯和缺失胚胎中异常的分化时序
之后,该团队在流产的神经管畸形胎儿中检测到5个位于PAK2基因的点突变。通过运用NanoString检测方法,发现携带PAK2突变的胎儿脑组织中PAK2的水平降低而BMP信号通路中多个基因的水平增加。同时,也发现PAK2突变点可影响PAK2蛋白的稳定性,抑制ATP转化ADP的水平,显著降低PAK2的活性形式pPAK2的水平,提示该突变位点影响了PAK2激酶活性。
最后,他们在斑马鱼中用CRISPR-Cas9 系统构建了pak2a的特异敲除模型。该模型在出生后48小时后在头部背前侧区域出现了一个明显的空腔,提示其神经管发育异常。最后在敲除pak2a的斑马鱼中过表达神经管畸形患者携带的PAK2突变位点,发现不能改善斑马鱼神经管畸形的表型。
综上,该研究以神经管特定发育事件(背外侧铰链点形成)为出发点、从细胞动态时序发育过程(单细胞测序技术)、分子机制(磷酸化激酶活性)和信号通路(BMP通路)等多水平,在多种脊椎类生物中阐明了PAK2在神经管发育的作用机制。
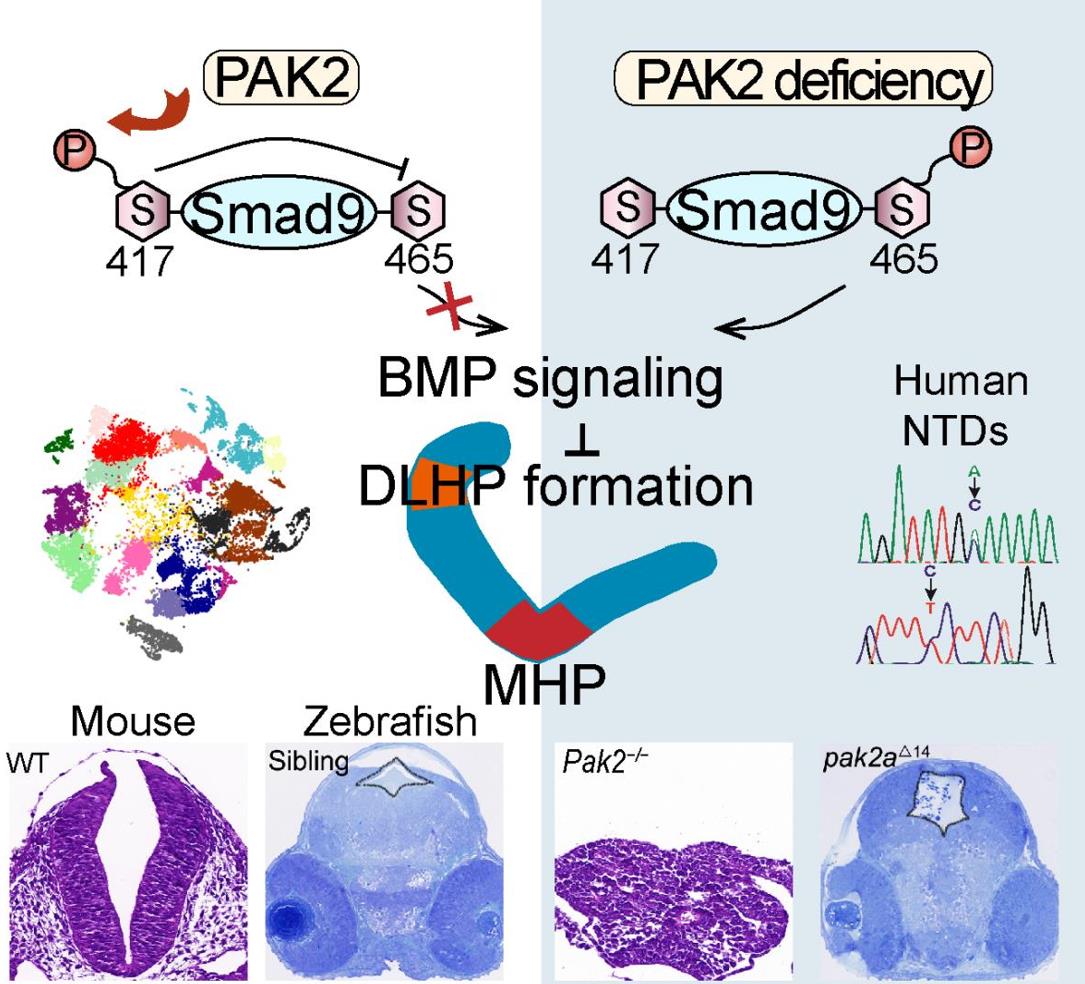
图2:PAK2在神经管发育的作用机制
北京生科院孙中生团队王彦副研究员,温州医科大学硕士生张开帆,首都儿科研究所郭金副研究员和杨淑艳助理研究员为该论文的共同第一作者,北京生科院孙中生研究员和首都儿科研究所张霆研究员为论文的共同通讯作者。该研究得到了国家自然科学基金和广东省重点研发计划项目等的研究资助。
原文链接:https://doi.org/10.1002/advs.202204018

